高中化学必修一混合物分离与粗盐提纯全攻略
化学大师
高中化学必修一
1.混合物的分离
①过滤:固体(不溶)和液体的分离。
②蒸发:固体(可溶)和液体分离。
③蒸馏:沸点不同的液体混合物的分离。
④分液:互不相溶的液体混合物。
⑤萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
2.粗盐的提纯
(1)粗盐的成分:主要是NaCl,还含有MgCl2、CaCl2、、泥沙等杂质
(2)步骤:
①将粗盐溶解后过滤;
②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;
③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;④蒸发、结晶得到精盐。
加试剂顺序关键: 在BaCl2之后; 盐酸放最后。
(3) 蒸馏装置注意事项: ①加热烧瓶要垫上石棉网; ②温度计的水银球应位于蒸馏烧瓶的支管口处; ③加碎瓷片的目的是防止暴沸;
④冷凝水由下口进,上口出。
(4) 从碘水中提取碘的实验时,选用萃取剂应符合原则:
①被萃取的物质在萃取剂溶解度比在原溶剂中的大得多;
②萃取剂与原溶液溶剂互不相溶;
③萃取剂不能与被萃取的物质反应。
3.离子的检验:
①SO42-:先加稀盐酸,再加BaCl2溶液有白色沉淀,原溶液中一定含有SO42-。Ba2++SO42-=BaSO4↓
②Cl-(用AgNO3溶液、稀硝酸检验)加AgNO3溶液有白色沉淀生成,再加稀硝酸沉淀不溶解,原溶液中一定含有Cl-;或先加稀硝酸酸化,再加AgNO3溶液,如有白色沉淀生成,则原溶液中一定含有Cl-。Ag++Cl-=AgCl↓。
③CO32-:(用BaCl2溶液、稀盐酸检验)先加BaCl2溶液生成白色沉淀,再加稀盐酸,沉淀溶解,并生成无色无味、能使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32-。
4.5个新的化学符号及关系
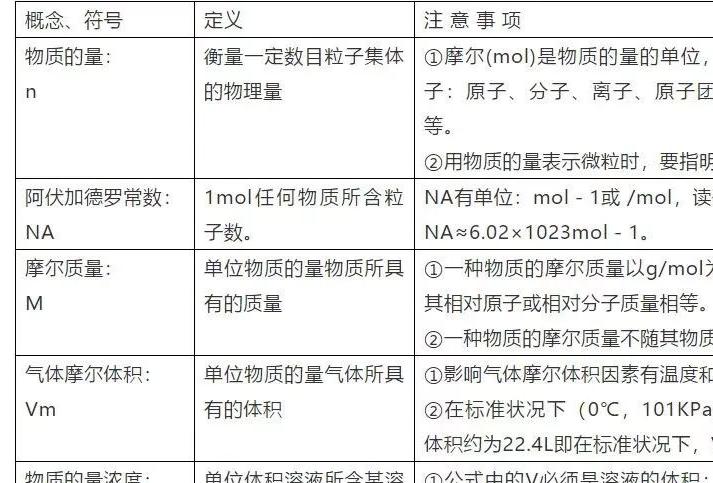
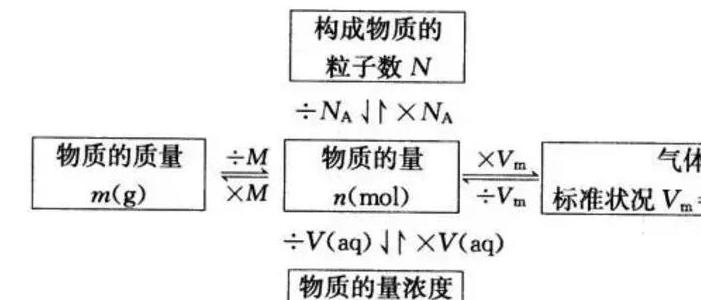
5.分散系
(1)分散系组成:分散剂和分散质,按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
(2)当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。

6.胶体:
(1)常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。
(2)胶体的特性:能产生丁达尔效应。区别胶体与其他分散系常用方法丁达尔效应。胶体与其他分散系的本质区别是分散质粒子大小。
(3)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。
7.电解质和非电解质
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下都不能导电的化合物。(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质。)
8.电解质和非电解质相关性质
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
(2)酸、碱、盐和水都是电解质(特殊:盐酸(混合物)电解质溶液)。
(3)能导电的物质不一定是电解质。能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
溶液能够导电的原因:有能够自由移动的离子。
电离方程式:要注意配平,原子个数守恒,电荷数守恒。
如:Al2(SO4)3=2Al3++3SO42-
9.离子反应:
(1)离子反应发生的条件:生成沉淀、生成气体、水。
(2)离子方程式的书写:(写、拆、删、查)
①写:写出正确的化学方程式。(要注意配平。)
②拆:把易溶的强电解质(易容的盐、强酸、强碱)写成离子形式,这些物质拆成离子形式,其他物质一律保留化学式。
③删:删除不参加反应的离子(价态不变和存在形式不变的离子)。
④查:检查书写离子方程式等式两边是否原子个数守恒、电荷数守恒。
10.常见易溶的强电解质有:三大强酸(H2SO4、HCl、HNO3),四大强碱[NaOH、KOH、Ba(OH)2、Ca(OH)2 (澄清石灰水拆,石灰乳不拆)],可溶性盐
11.离子方程式正误判断:(看几看)
①看是否符合反应事实(能不能发生反应,反应物、生成物对不对)。
②看是否可拆。
③看是否配平(原子个数守恒,电荷数守恒)。
④看“=”“ ”“↑”“↓”是否应用恰当。
12.离子共存问题(1)由于发生复分解反应(生成沉淀或气体或水)的离子不能大量共存。生成沉淀:AgCl、BaSO4、BaSO3、BaCO3、CaCO3、Mg(OH)2、Cu(OH)2等。生成气体:CO32-、HCO3-等易挥发的弱酸的酸根与H+不能大量共存。生成H2O:①H+和OH-生成H2O。②酸式酸根离子如:HCO3-既不能和H+共存,也不能和OH-共存。如:HCO3-+H+=H2O+CO2↑, HCO3-+OH-=H2O+CO32-
(2)审题时应注意题中给出的附加条件。
①无色溶液中不存在有色离子:Cu2+、Fe3+、Fe2+、MnO4-(常见这四种有色离子)。
②注意挖掘某些隐含离子:酸性溶液(或pH<7)中隐含有H+,碱性溶液(或pH>7)中隐含有OH-。
③注意题目要求“大量共存”还是“不能大量共存”。
13.氧化还原反应
(1)氧化还原反应的本质:有电子转移(包括电子的得失或偏移)。
(2)氧化还原反应的特征:有元素化合价升降。
(3)判断氧化还原反应的依据:凡是有元素化合价升降或有电子的转移的化学反应都属于氧化还原反应。
(4)氧化还原反应相关概念:
还原剂(具有还原性):失(失电子)→升(化合价升高)→氧(被氧化或发生氧化反应)→生成氧化产物。
氧化剂(具有氧化性):得(得电子)→降(化合价降低)→还(被还原或发生还原反应)→生成还原产物。
【注】一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找。

14.氧化性、还原性强弱的判断
根据氧化还原反应方程式在同一氧化还原反应中,氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
15.如果使元素化合价升高,即要使它被氧化,要加入氧化剂才能实现;
如果使元素化合价降低,即要使它被还原,要加入还原剂才能实现
16.钠 Na的特质
(1)单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
(2)钠的存在:以化合态存在。
(3)钠的保存:保存在煤油或石蜡中。
(4)钠在空气中的变化过程:Na→Na2O→NaOH→→·10H2O(结晶)→(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是)。
17.钠与O2反应
常温下:4Na + O2=2Na2O (新切开的钠放在空气中容易变暗)
加热时:2Na + O2==Na2O2(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。)
Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性。
+2H2O=4NaOH+O2↑ +2CO2=+是呼吸面具、潜水艇的供氧剂,Na2O2具有强氧化性能漂白。
18.钠与H2O反应2Na+2H2O=2NaOH+H2↑
离子方程式:2Na+2H2O=2Na++2OH-+H2↑(注意配平)
实验现象:“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
19.钠与盐溶液反应
如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,
有关化学方程式:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=Cu(OH)2↓+
总的方程式:2Na+2H2O+CuSO4=Cu(OH)2↓++H2↑
实验现象:有蓝色沉淀生成,有气泡放出
K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应
20.钠与酸反应:2Na+2HCl=2NaCl+H2↑(反应剧烈)
离子方程式:2Na+2H+=2Na++H2↑
21.铝 Al的特质
(1)单质铝的物理性质:银白色金属、密度小(属轻金属)、硬度小、熔沸点低。
(2)单质铝的化学性质
22.铝与O2反应:常温下铝能与O2反应生成致密氧化膜,保护内层金属。加热条件下铝能与O2反应生成氧化铝:4Al+3O2==
23.常温下Al既能与强酸反应,又能与强碱溶液反应钠在常温下切开后表面变暗,均有H2生成,也能与不活泼的金属盐溶液反应:
2Al+6HCl=+3H2↑ ( 2Al+6H+=2Al3++3H2↑ )
2Al+2NaOH+2H2O=+3H2↑ ( 2Al+2OH-+2H2O=2AlO2-+3H2↑ )
2Al+3Cu(NO3)2=2Al(NO3) 3+3Cu ( 2Al+3Cu2+=2Al3++3Cu )注意:铝制餐具不能用来长时间存放酸性、碱性和咸的食品。
24.铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应Fe2O3+2Al == 2Fe+Al2O3,Al 和 Fe2O3的混合物叫做铝热剂。利用铝热反应焊接钢轨。
25.铁的特质
单质铁的物理性质:铁片是银白色的,铁粉呈黑色,纯铁不易生锈,但生铁(含碳杂质的铁)在潮湿的空气中易生锈。(原因:形成了铁碳原电池。铁锈的主要成分是Fe2O3)。
化学大师
- 1vivo X200 Ultra 舍弃一英寸主摄?传闻中的蓝厂超大杯影像详解
- 2东风悦达起亚k3报价及图片,供了多种动力选择,以满足不同消费者的需
- 3你的幸福是我们最好的礼物,有时候,最好的礼物并不是一件物品,而是一
- 4传祺gs4和哈弗h6哪个好,外观风格迥异,挑来挑去真是让人头疼
- 5怎样避免冬天刷车冻,只要咱们掌握了应对技巧和预防措施,这些问题还
- 6丰田车suv全部车型,它不仅继承了丰田的品质,还融入了流行的设计元
- 7登陆页面(腾达路由器)路由网,一定要在浏览器的地址栏中仔细输入IP
- 8什么能让厚冰快速化掉,这方法成本低,操作简单但得注意,别撒太多
- 9冬天刷车应该注意什么,不管哪个季节,洗车高峰期去洗车都是这么个情
- 10洗车店冬天怎么才不冻,在路上遇到这种情况,那可就太危险了
- 11用不了5年,增程汽车就不吃香了?不是瞎扯,3大理由超实在!
- 12国家级寒潮预警确定升级,超大范围雨雪在扩大!权威预报:局部特大暴雪
- 13suv销量排行榜前十口碑最好品牌,其产品线丰富,覆盖多个细分市场
- 14汽车保养口诀,要是为了省钱就忽略了保养,那车辆出问题的几率可就大
- 15REDMI K80 Pro影像对标小米15 产品经理:除了徕卡 能给的都给了

推荐

最新标签











 (24小时内及时处理)
(24小时内及时处理)